Unser Wissen im biomedizinischen Bereich erweitert sich ständig und oft offenbart sich erst im Rückblick, wie wahnsinnig weit wir schon gekommen sind. Bei all den medizinischen Errungenschaften fällt es leicht, zu vergessen, wie lang und beschwerlich der Weg dorthin sein kann. Hier wollen wir euch die Preisträger der Nobelpreise für Medizin oder Physiologie der letzten Jahre vorstellen, die für ihre außerordentliche Forschung geehrt wurden. Tierversuche spielten dabei immer wieder eine Rolle, doch sind sie auch nur eines der vielen Puzzlestücken, die am Ende das ganze Bild ergeben.
Alle Bilder und Illustrationen haben wir aus den Press Releases der jeweiligen Jahre von der offiziellen Webseite der Nobelpreise übernommen.
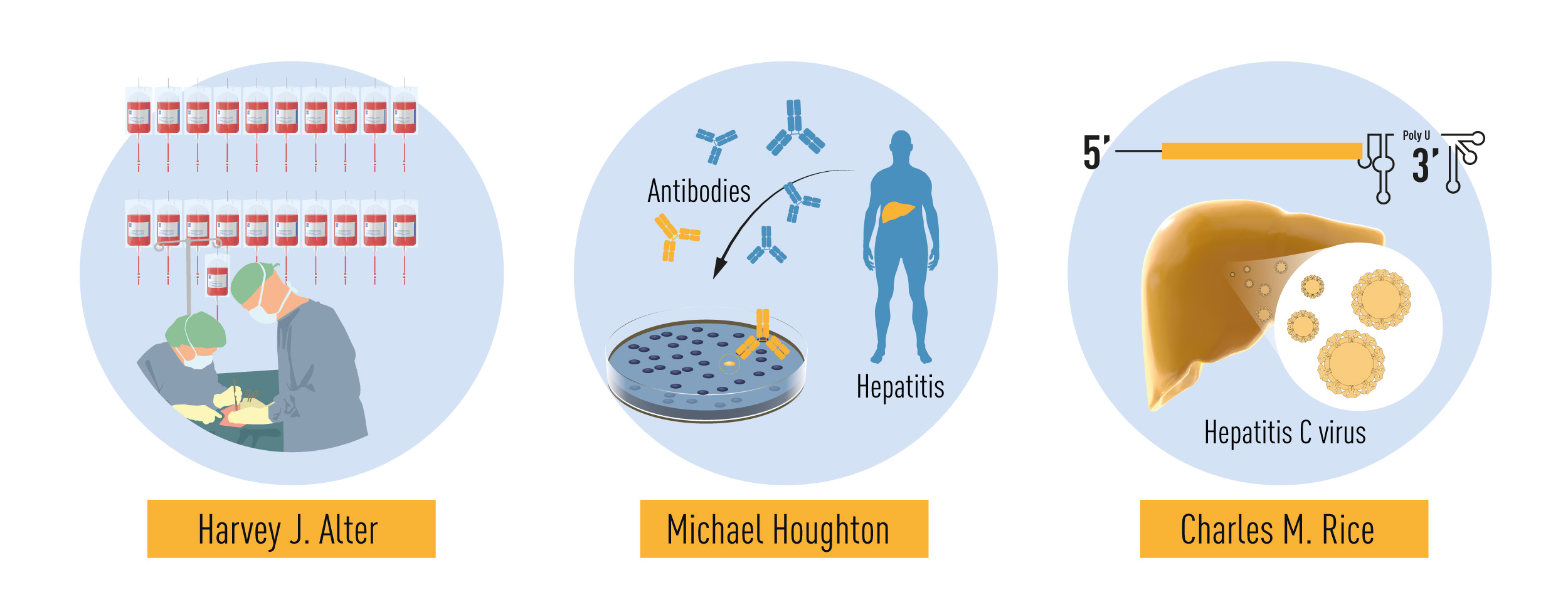
2020 - Das Hepatitis-C-Virus
Harvey J. Alter, Michael Houghton und Charles M. Rice
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Der Nobelpreis für Physiologie oder Medizin geht in diesem besonderen Jahr 2020 an drei Wissenschaftler, die ein Virus entdeckten und beschrieben: Harvey J. Alter, Michael Houghton und Charles M. Rice. Allerdings handelt es sich dabei nicht um das SARS-CoV-2-Virus, das uns alle dieses Jahr in Atem hält, sondern um das Hepatitis-C-Virus.
Hepatitis C ist eine Entzündung der Leber, die akut oder chronisch verlaufen kann und zu den Hauptursachen für Leberzirrhose und Leberkrebs gehört. Das Virus, das Hepatitis C verursacht, heißt naheliegenderweise Hepatitis-C-Virus, ein RNA-Virus aus der Flavivirus-Familie. Es wird über das Blut übertragen, bspw. bei Transfusionen von nicht-geprüftem Blut. Nach erfolgreicher Entdeckung und Beschreibung ist es gelungen, eine effiziente antivirale Therapie gegen das Virus zu entwicklen. Heute können über 95 % der Erkrankten mit entsprechender Therapie geheilt werden. Leider haben viele der weltweit 58 Millionen chronisch Infizierten kaum Zugang zu einem Gesundheitssystem, das Diagnose und Behandlung ermöglicht. Bislang gibt es keine Impfung.
Bei der Beschreibung des Hepatitis-C-Virus spielten Tierversuche eine wichtige Rolle: Charles M. Rice konnte bei Versuchen in Schimpansen nachweisen, dass das Virus allein ausreichte, um eine Hepatitis hervorzurufen. Heute sind Versuche in Menschenaffen wie Schimpansen in der gesamten EU verboten.
Neben Hepatitis C sind zwei weitere Arten bekannt, die zuvor entdeckt worden waren. Hepatitis A, die durch kontaminiertes Wasser oder kontaminierte Nahrung übertragen wird, und Hepatitis B, die ebenso wie Hepatitis C durch Blutkontakt übertragen wird. Bereits 1976 wurde Baruch Blumberg für die Entdeckung des Hepatitis-B-Virus mit dem Medizin-Nobelpreis ausgezeichnet. Auf Grundlage seiner Arbeit wurden nicht nur diagnostische Tests entwickelt, sondern auch eine effektive Impfung.
2019 - Zellatmung
William G. Kaelin Jr., Sir Peter J. Ratcliffe und Gregg L. Semenza
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Einatmen. Ausatmen. Einatmen. Ausatmen.
Wir – und damit all unsere Zellen – brauchen den Sauerstoff aus der Luft. Wie aber spüren Zellen Sauerstoffmangel? Wie reagieren sie auf die unterschiedliche Verfügbarkeit von Sauerstoff?
Gregg Semenza vom Johns Hopkins Institute for Cell Engineering in Baltimore entdeckte HIF, ein Protein, das als Sauerstoffsensor in den Zellen dient. Über die HIF-Menge in der Zelle wird die Expression von verschiedenen Genen reguliert, wodurch die Zellatmung an verschiedenen Sauerstoffmengen angepasst werden kann.
William Kaelin von der Harvard Medical School in Boston forschte am Protein VHL, das abhängig vom Sauerstoffgehalt mehr oder weniger aktiv ist und damit ebenfalls zur Regulation der Zellantwort beiträgt.
Peter Ratcliffe vom Francis Crick Institute in London entdeckte schließlich einen Link zwischen HIF und VHL – Wissen, das wesentlich zu unserem Verständnis der Regulation der Zellatmung beigetragen hat.
Wir brauchen eine gute Sauerstoffversorgung unserer Zellen für ganz grundlegende Prozesse. Die Anpassung der Zellatmung auf verschiedene Sauerstofflevel spielt u.a. bei der Bildung neuer roter Blutkörperchen und Blutgefäße eine Rolle. Ebenso ist sie enorm wichtig bei der Entwicklung des Fötus im Mutterleib. Darüber hinaus kann sie unser Immunsystem „finetunen“.
Bei all diesen essentiellen Aufgaben ist es nicht verwunderlich, dass eine fehlerhafte Sauerstoffversorgung der Zellen, z.B. hervorgerufen durch eine gestörte Regulation, bei verschiedenen Krankheiten eine Rolle spielt. So leiden bspw. Patienten mit chronischem Nierenversagen häufig unter schwerer Blutarmut – der mit der Bildung neuer Blutkörperchen entgegengewirkt werden könnte. Die Sauerstoffversorgung spielt aber auch bei Krebs eine wichtige Rolle. In Tumorgewebe wird die Bildung von Blutgefäßen stimuliert, um eine optimale Proliferation des Tumors zu ermöglichen. Wäre es möglich, dort einzugreifen, könnte man möglicherweise das Fortschreiten von Tumoren hemmen. Aktuelle Forschung arbeitet nun fieberhaft daran, das neu gewonnene Grundlagenwissen in die angewandte Medizin zu übertragen und Medikamente zu entwickeln, die die Sauerstoff-Sensing-Machinerie entsprechend hemmen oder aktivieren, um ein Krankheitsbild zu verbessern. Wir hoffen auf schnelle Erfolge und werden berichten!
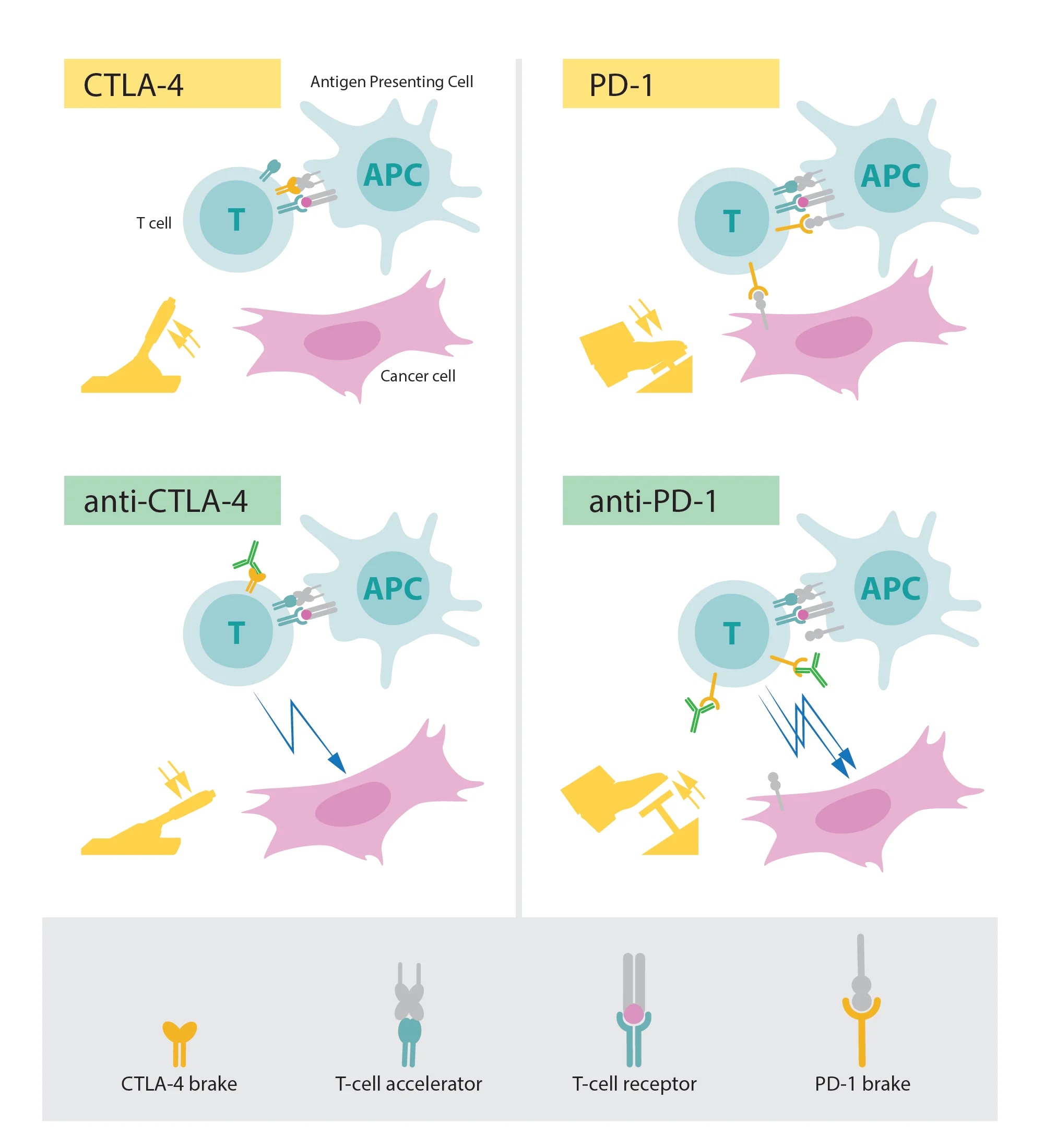
2018 - Checkpoint-Inhibitoren in der Krebstherapie
James P. Allison und Tasuku Honjo
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Krebs ist eine äußerst komplexe Krankheit, welche fast jedes Organ im Körper befallen kann. Oftmals wird von Laien nur von „dem Krebs“ gesprochen und die Frage gestellt, ob es denn nicht bald eine Behandlung oder ein Medikament für „den Krebs“ gäbe. Die Wirklichkeit sieht leider wesentlich vielschichtiger aus. Je nachdem, welches Organ betroffen ist, muss der Patient unterschiedlich behandelt werden. Dabei spielen auch spezielle Mutationen innerhalb einer Krebsart eine sehr wichtige Rolle. Daher wird es in der Klinik immer wichtiger, die Krebszellen der Patienten auf Genom-Ebene zu untersuchen, um die Behandlung genau auf diese abzustimmen.
Da jeder Patient und jeder Krebs sich ein bisschen unterscheiden, liegt der Fokus seit einigen Jahren darauf, sich diesen Unterschied zunutze zu machen. Und zwar soll das Immunsystem des Patienten aktiv dabei unterstützt werden, den eigenen Krebs zu bekämpfen. Zu den wichtigsten Entdeckungen der Immuntherapie zählen die sogenannten Checkpoint Inhibitors, welche Dank der Arbeit von James P. Allison and Tasuku Honjo entwickelt werden konnten. Die beiden Wissenschaftler haben bestimmte Moleküle auf der Oberfläche von Immunzellen entdeckt, welche bei gesunden Menschen dazu dienen das Immunsystem vor einer Überreaktion zu bewahren. In Krebspatienten führen sie aber dazu, dass das Immunsystem in seinem Kampf gegen die Krebszellen beeinträchtigt wird. Checkpoint Inhibitors sind Antikörper, welche sich gegen diese herunterregulierenden Moleküle richten und somit das Immunsystem wieder stärken. Sie gehören mittlerweile zum Standard bei der Krebstherapie.
Die Forschung von James P. Allison and Tasuku Honjo fällt unter den sogenannten Bereich der Grundlagenforschung. Im Rahmen ihrer Forschung kamen auch Tierversuche zum Einsatz. Diese sind damit ein gutes Beispiel für Tierversuche, die nicht nur entscheidend zu unserem Wissen und Grundverständnis über die Regulation von Immunzellen beigetragen haben, sondern darüber hinaus entscheidende Erkenntnisse für die Entwicklung einer besseren Krebstherapie geliefert haben.
2017 –Unsere biologische Uhr
Jeffrey C. Hall, Michael Rosbash und Michael W. Young
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Die biologische Uhr tickt. Aber wie? Das Leben hat sich der Rotation der Erde und damit dem Tag/Nacht-Wechsel angepasst. Bakterien, Pflanzen und Tiere folgen einem regelmäßigen zirkadianen Rhythmus, der zwar subtil durch Licht justiert werden kann, aber doch einem regelmäßigen Takt folgt. Das kennen wir alle vom Jetlag und der Zeitumstellung, wenn unsere innere Uhr erstmal normal weitertickt. Woher weiß unsere innere Uhr, wie spät es ist?
Das dafür nötige Werkzeug und Sensorium, ist eine physiologische Meisterleistung der Zellen. Für die Entdeckung der molekularen Mechanismen dahinter wurden 2017 Jeffrey C. Hall, Michael Rosbash und Michael W. Young mit dem Medizin-Nobelpreis ausgezeichnet.
Als Modellorganismen dienten in der Forschung Fliegen. In ihnen konnte das „Uhrenprotein“ PER identifiziert werden, das durch das period-Gen kodiert ist. Die Proteinlevel von PER in der Zelle schwanken im 24-Stunden-Takt: nachts sammelt es sich in der Zelle an und tagsüber wird es abgebaut. Reguliert wird PER über einen Feedback-Mechanismus – oder besser gesagt: es reguliert sich selbst. Das Protein wandert aus dem Zytoplasma der Zellen, wo es von seiner mRNA-Bauanleitung gebaut (translatiert) wurde, zurück in den Zellkern, um die Transkription, also das Entstehen der eigenen mRNA-Bauanleitung zu unterbinden. Heute in allen Biologielehrbüchern erklärt, war diese Art des Feedback-Loops in den 1980er-Jahren noch nicht akzeptiert oder belegt. Dieser Mechanismus allein konnte aber nicht alle Fragen beantworten. Wie koordinieren sich alle Zellen eines Organismus? Wie wird der Startpunkt festgelegt? Wie reagiert die innere Uhr auf veränderte Tageslängen in Sommer und Winter oder eben auf Jetlag? Als regulatorisches Element kam das Protein TIM dazu, später gefolgt von DBT, CLK und CYC. Die zugrunde liegende Erkenntnis: Der Biorhythmus kann etwa verlängert oder verkürzt werden, indem der Abbau oder der Transport zum Einsatzort von einzelnen Komponenten beschleunigt oder gebremst wird. Etwas genauer nachlesen könnt ihr das hier.
Heute wissen wir außerdem: Fast alle bei der Taufliege entdeckten Uhrproteine finden sich so ähnlich auch bei Mäusen und Menschen. Ein wunderbares Beispiel für die (eingeschränkte) Übertragbarkeit zwischen Mensch und Tier, oder?! Die Grundzüge der inneren Uhr haben wir sogar mit Pflanzen gemein. Allerdings kommt erwiesenermaßen zumindest bei Säugetieren das Gehirn dazu: Damit alle Zellen des Körpers im Takt bleiben, gibt es regulierende „Zentraluhr“ im Gehirn, die darüber wacht, dass alle Prozesse sinnvoll koordiniert oszillieren.
2016 – Autophagie
Yoshinori Ohsumi
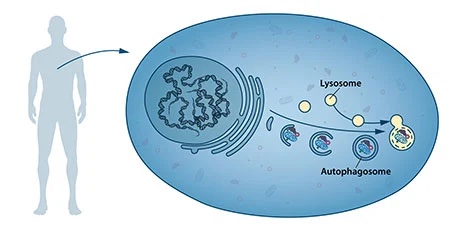
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
In Zellen läuft so einiges ab – ständig werden Moleküle aufgenommen, transportiert, abgebaut, repariert, umfunktioniert und wieder abgegeben. Klar, dass bei diesen ganzen Abläufen auch mal was schiefgeht und sich überschüssiges Material als „Müll“ in der Zelle ansammelt. Daher hat die Zelle ihr
eigenes Recyclingsystem entwickelt, das man als Autophagie bezeichnet (wörtlich: „sich-selbst-verzehren“). Diese zelluläre Wiederverwertung wurde in den 90er Jahren vom Zellbiologen Yoshinori Ohsumi an Hefezellen erforscht [1,2] und findet sowohl in pflanzlichen als auch tierischen Zellen statt. Mittlerweile ist klar, dass dieser grundlegende zelluläre Prozess bei einer Reihe von schwerwiegenden Erkrankungen gestört ist, wie z.B. Muskeldystrophie, Parkinson oder Chorea Huntington [3,4]. Bei verschiedenen Krebserkrankungen scheint eine Überaktivierung von Autophagie das Wachstum von Tumorzellen zu fördern. Erste klinische Studien testen bereits die Effektivität von Autophagie-Inhibitoren als unterstützende Therapie [5]. Die Arbeit von Ohsumi zeigt auf beeindruckende Weise, dass die Forschung an grundlegenden biologischen Abläufen zum wissenschaftlichen Fortschritt beiträgt. Oder anders ausgedrückt – wie es bereits Max Planck sagte: „Dem Anwenden muss das Erkennen vorausgehen“.
[1] Takeshige et al., The Journal of Cell Biology, Oct 1992, 119 (2) 301-311
[2] Baba et al., The Journal of Cell Biology, Mar 1994, 124 (6) 903-913
[3] Karabiyik et al., Essays Biochem. 2017 Dec 12;61(6):711-720.
[4] Saha et al., Biomedicine & Pharmacotherapy, Vol. 104, 2018, 485-495
[5] Levy et al., Nat Rev Cancer, 2017 17(9): 528–542
2015 – Therapien gegen Parasiten
William C. Campbell, Satoshi Omura und Tu Youyou
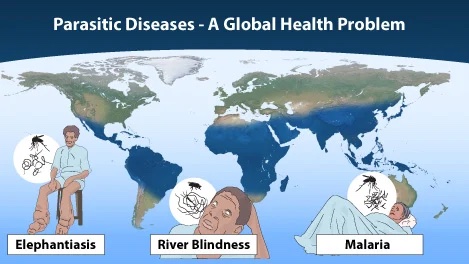
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Durch Parasiten hervorgerufene Krankheiten kennen die meisten von uns wahrscheinlich nur aus der Infosprechstunde im Tropeninstitut vor der Reise in ein tropisches Land. Weltweit sind jedoch Millionen Menschen betroffen. 2015 wurde der Medizin-Nobelpreis daher für die Entwicklung von Therapeutika gegen parasitäre Krankheiten verliehen: an William C. Campbell und Satoshi Omura für ihre Entdeckung des Avermectins, das gegen Fadenwürmer eingesetzt wird, die zu Flussblindheit oder lymphatischen Filariosen führen können, und an Tu Youyou für die Entdeckung des Artemisinins, einem bis heute in Kombination mit Partnermedikamenten eingesetzten Anti-Malaria-Mittel.
Das Anti-Malaria-Mittel Artemisinin hat eine interessante Entdeckungsgeschichte. Tu Youyou wendete sich auf der Suche nach neuartigen Substanzen gegen Malaria der traditionellen chinesischen Medizin zu. In einem groß angelegten Screen von pflanzlichen Heilmitteln in Malaria-infizierten Tieren stieß sie auf einen Extrakt der Artemisia annua-Pflanze. Nach mühsamer Arbeit gelang es schließlich die aktive Komponente der Pflanze zu identifizieren und deren Anti-Malaria-Wirkung in Tier und später im Menschen zu zeigen. Chemische Modifikationen des Artemisinin eröffneten eine ganz neue Klasse der Anti-Malaria-Mittel.
Leider treten heute weltweit immer mehr resistente Malariaparasiten auf. Daher wird weiter an Malaria geforscht. Ein wichtiges Standbein bilden dabei auch Tierversuche: im Mäuse-Malariaerreger Plasmodium berghei wird viel Grundlagenforschung betrieben, da sich diese Parasiten leichter genetisch modifizieren lassen und z.T. geringeren Biosicherheitsklassen unterliegen (geringere Infektionsgefahr für den/die ExperimentatorIn). Dank moderner Methoden der genetischen Veränderung haben wir aber heute schon viele neue Werkzeuge in der Hand, die das Arbeiten mit dem humanen Erreger erleichtern, sodass die Zahl der eingesetzten Tiere hoffentlich immer weiter reduziert werden kann, während den Resistenzen entgegengearbeitet wird.
2014 – Unser inneres Navigationssystem
John O’Keefe, May-Britt Moser und Edvard Moser
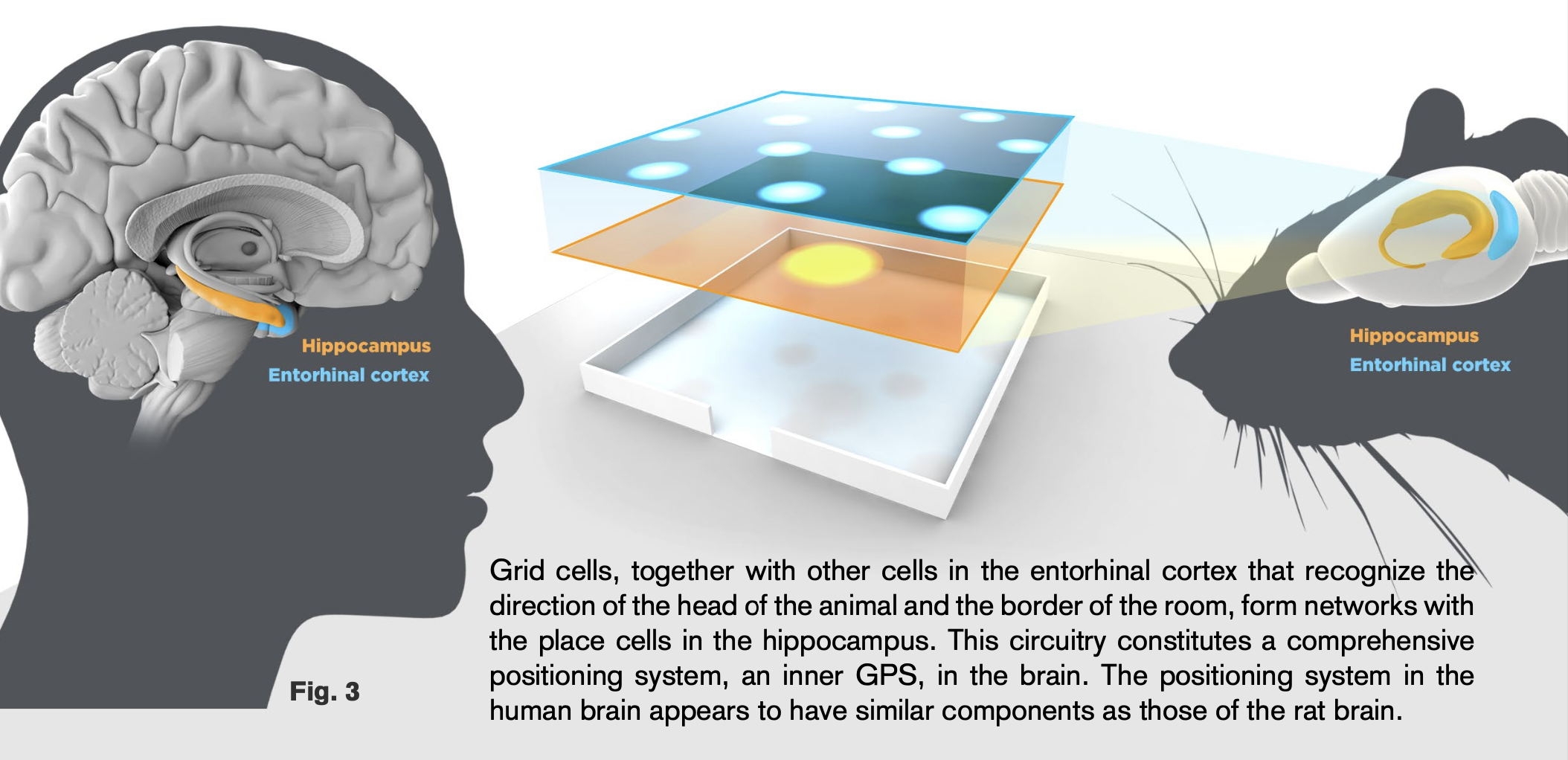
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Wie entstehen im Gehirn Raum und Zeit? Der irisch-stämmige Forscher O’Keefe hatte in den 1970er Jahren im Rattengehirn die sogenannten place cells (dt.: Ortszellen) im Hippocampus entdeckt. Diese Zellen sind immer dann aktiv, wenn die Ratte sich an einem bestimmten Ort im Raum aufhält. Sie codieren sozusagen die Umgebung und sind die Grundlage für eine mentale Karte im Gehirn. Darauf aufbauend entdeckte das Forscherehepaar May-Britt und Edvard Moser – ebenfalls im Rattengehirn – 2005 die sog. grid cells (dt.: Gitterzellen). Diese Zellen sind ebenfalls für die räumliche Orientierung wichtig und codieren noch weitere Informationen.
Inzwischen sind all diese (und noch weitere) Zelltypen, die für die Orientierung – also das Bewusstsein von Raum und Zeit – essentiell sind, bei anderen Tieren und auch bei uns Menschen bestätigt worden. Die Forschung dieser Nobelpreisträger hat einen ganzen Forschungszweig innerhalb der Neurowissenschaften eröffnet und hat zur Entwicklung neuer Methoden (z.B. kabellose Übertragung von Nervenzellimpulsen zu einem Messgerät, kabellose Minimikroskope, um einem Tier bei vollem Bewusstsein schmerzfrei ins Gehirn gucken zu können) beigetragen. Besonders die Mosers gehen mit ihren Ratten in vorbildlicher Weise um, weil sie auf deren Mitarbeit und ihr Wohlergehen für ihre Forschung angewiesen sind. Um die Atmosphäre in ihrem Labor zu beschreiben, hat May-Britt Moser diesen Satz geprägt: Happy people, happy animals. Wer sich selbst davon überzeugen möchte, kann dies in einer beeindruckenden 3D-Tour durch das Moser-Lab tun.
2013 – Transportprozesse in unseren Zellen
James Rothman, Randy Schekman und Thomas Süderhof
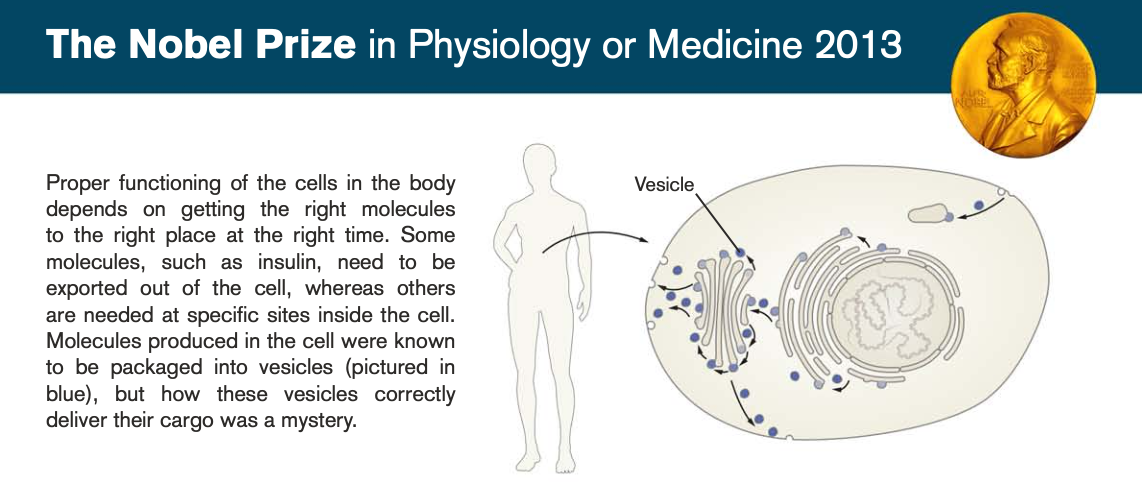
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Zellen sind voll mit kleinen und großen Molekülen – und die müssen zu einer bestimmten Zeit an einem bestimmten Ort sein. Diffusion allein reicht da nicht. Die Stoffe müssen also gezielt transportiert werden. Wie machen Zellen das?
Der Medizin-Nobelpreis 2013 ging an die US-Amerikaner James Rothman, Randy Schekman und den in Deutschland geborenen Thomas Südhof, der seit den 80er Jahren ebenfalls in den USA lebt. Sie wurden für ihre Forschungen zu Transportprozessen in Zellen ausgezeichnet.
In Zellen läuft der Transport von großen Molekülen (Proteine, RNA) u.a. über kleine Bläschen, die wie Pakete funktionieren, sogenannte Vesikel. Diese kugelförmigen Pakete werden am Produktionsort in der Zelle geschnürt, über spezielle Leitungsbahnen transportiert und verschmelzen am Zielort mit dort vorhandene Zellstrukturen (z.B. Organellen oder der äußeren Zellmembran).
Dieser Zelltransport ist es auch, der Signalübertragung im Nervensystem überhaupt erst möglich macht. Die chemischen Botenstoffe wie Dopamin, Serotonin, Glutamat oder Acetylcholin, mit denen die Nervenzellen untereinander oder mit unseren Muskeln kommunizieren, werden zum Teil im Zellkörper produziert und müssen dann zu den Zellenden, den Synapsen, transportiert werden. Das sind bei großen Tieren bis zu mehreren Metern an Strecke, die die Botenstoffe in den Vesikelpaketen da zurücklegen müssen! An der Synapse müssen sie dann millisekundengenau und in der exakt richtigen Zahl mit der Zellmembran verschmelzen und ihre Botenstoff-Ladung freisetzen, um so z.B. Bewegungen (Muskelkontraktionen) punktgenau zu steuern.
Einige Nervengifte, wie etwa Botox oder das Tetanus-Toxin, wirken, indem sie genau diesen Verschmelzungsprozess, den insbesondere Südhof und Rothman erforschten, blockieren.
Diese grundlegenden Erkenntnisse haben noch deutlich weitreichendere Bedeutung für viele Krankheiten, bei denen solche Transportprozesse verändert oder gestört sind. So steuern diese Prozesse zum Beispiel die Insulinausschüttung, die bei Diabetes gestört sein kann, oder den Eintritt von Viren in unsere Körperzellen (z.B. HIV).
In diesem Video reflektiert Tom Südhof über den Nutzen von Tierversuchen, insbesondere in der Grundlagenforschung, was ihn antreibt, auch nach dem Nobelpreis immer weiter zu forschen, und warum Wissenschaftler ihre Arbeit besser und ehrlicher erklären müssen. Das Video wurde bei einer Diskussion mit Schülerinnen und Schülern zum Thema Tierversuche aufgenommen.
2012 – Induzierte pluripotente Stammzellen
John Gurdon und Shin’ya Yamanaka
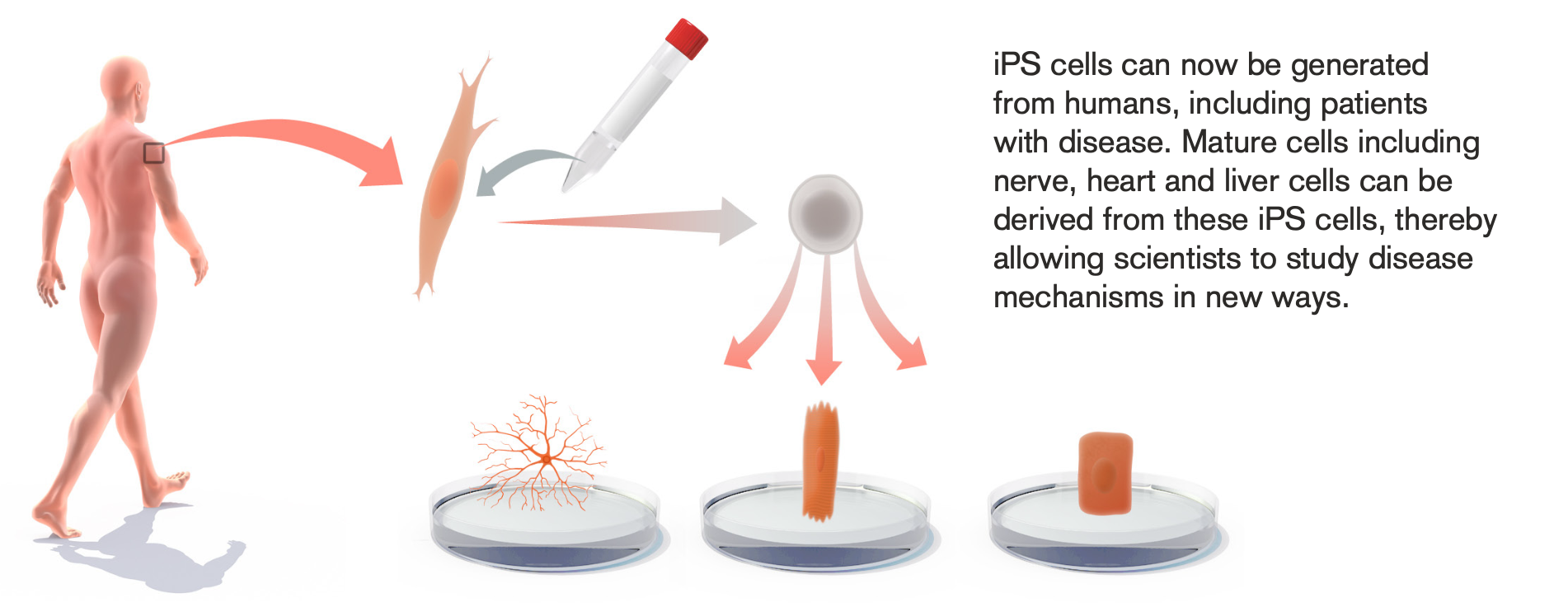
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Vor über 40 Jahren entfernte der John Gurdon den Zellkern einer Eizelle von Kaulquappen und ersetzte ihn durch den Zellkern einer differenzierten Darmzelle. Die modifizierten Eizellen entwickelten sich zu normalen Kaulquappen – und nicht etwa zu einer Zellkultur aus Darmzellen, wovon man damals felsenfest überzeugt war.
Es dauerte dann lange, bis die Schalter für diese Reprogrammierung gefunden wurden. Shin‘ya Yamanaka von der Universität Kyōto musste 2006 bei den Hautzellen, die er von Mäusen gewonnen hatte, nur vier sogenannte Transkriptionsfaktoren aktivieren. Derart reprogrammierte Zellen nehmen Gestalt und Eigenschaften von embryonalen Stammzellen an. Sie werden heute induzierte pluripotente Stammzellen (iPS-Zellen) genannt und sind ein vielversprechender Ansatz in Medizin und Wissenschaft. Einerseits ist die Grundlagenorschung damit weniger auf embryonale Stammzellen angewiesen, die schwer erreichbar sind und deren Verwendung ethische Bedenken aufwerfen. Andererseits können iPS-Zellen theoretisch in jede Körperzelle eines Patienten differenziert werden und eröffnen somit vielfältige medizinische Anwendungsgebiete von Morbus Parkinson über Diabetes bis hin zu Krebsbehandlungen.
2011 – Dendritsche Zellen
Bruce Beutler, Jules Hoffmann und Ralph M. Steinman
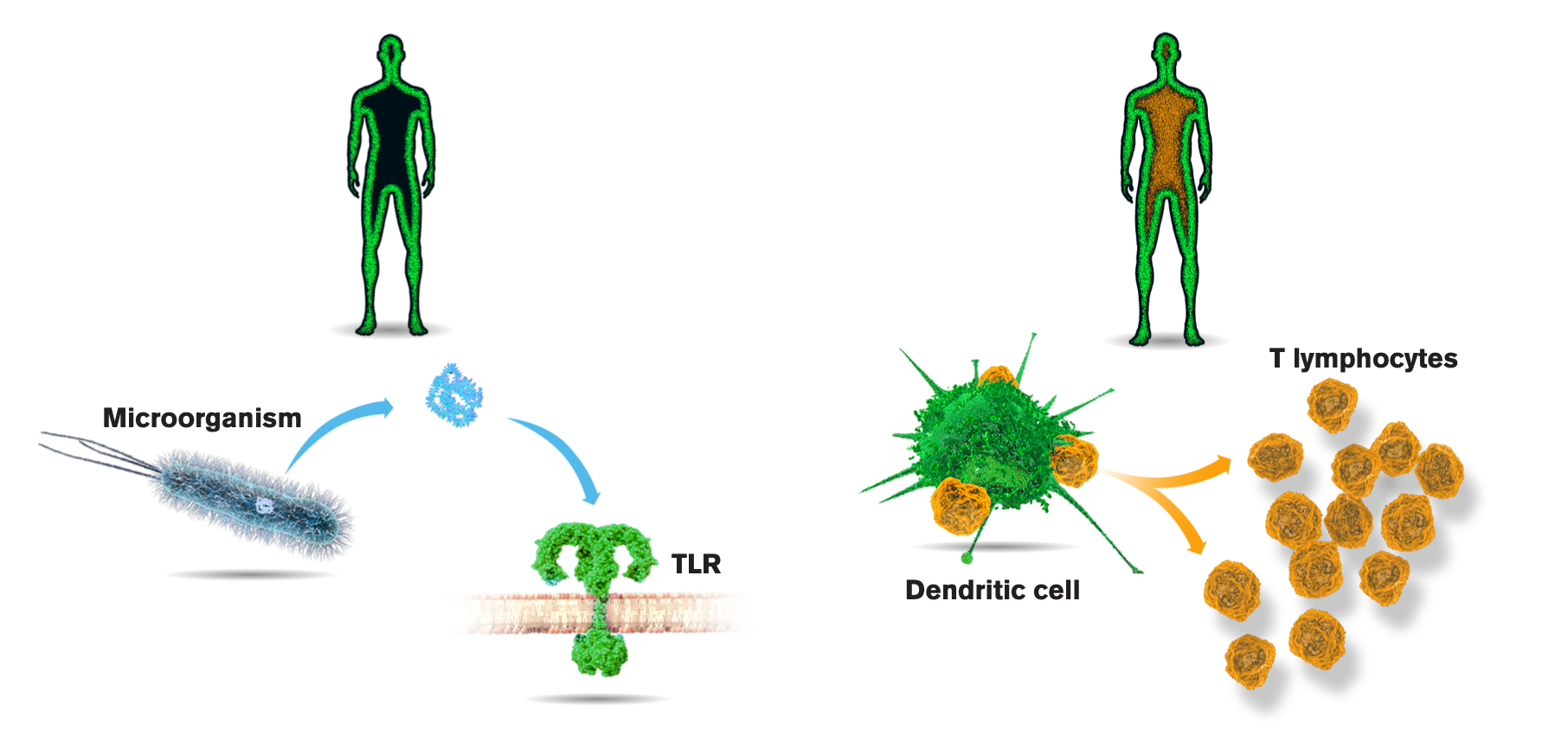
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Das Immunsystem ist ein komplexes Zusammenspiel aus einer Vielzahl von Zellen. Um das Ganze noch zu verkomplizieren, wird das Immunsystem in zwei Säulen unterteilt: zum einen das angeborene Immunsystem und zum anderen das adaptive Immunsystem. Das angeborenen Immunsystem besitzt jeder Mensch bereits von Geburt an. Das adaptive Immunsystem hingegen bildet sich erst im Laufe des Lebens aus und ist in der Lage ein Immungedächtnis zu bilden, ein Mechanismus, den man sich auch bei Impfungen zunutze macht. Bruce Beutler und Jules Hoffmann wurden für ihre Enrdeckungen über die Aktivierung der angeborenen Immunität 2011 mit dem Medizin-Nobelpreis ausgezeichnet.
Für die Gesundheit eines Menschen ist es äußerst wichtig, dass das angeborene und das adaptive Immunsystem in der Lage sind, miteinander zu kommunizieren. Eine der wichtigsten Brücken hierbei sind die dendritischen Zellen (DC), für deren Entdeckung Ralph M. Steinman ebenfalls 2011 den Medizin-Nobelpreis erhielt. DCs sind in der Lage Antigene, wie zum Beispiel Oberflächenmoleküle von Bakterien oder Viren, aufzunehmen, zu prozessieren und anschließend Zellen des adaptiven Immunsystems zu präsentieren. Diese wiederum können dann eine spezifische Immunantwort auslösen, z.B. durch die Bildung von spezifischen Antikörpern gegen die Fremdkörper, aber auch auf unzähligen anderen Wegen der Immunabwehr.
Auch in vivo Experimente, vor allem im Mausmodell, haben bei seiner Forschung eine sehr wichtige Rolle gespielt. Gerade Mäuse sind bei der Erforschung des Immunsystems unerlässlich und helfen uns dabei, die komplexen Vorgänge des Immunsystems mit all seinen Interaktionen zwischen verschiedensten Zelltypen, die zum Teil noch nicht ausreichend beschrieben sind, Stück für Stück besser zu verstehen.
2010 – In-vitro-Fertilisation
Robert Edwards
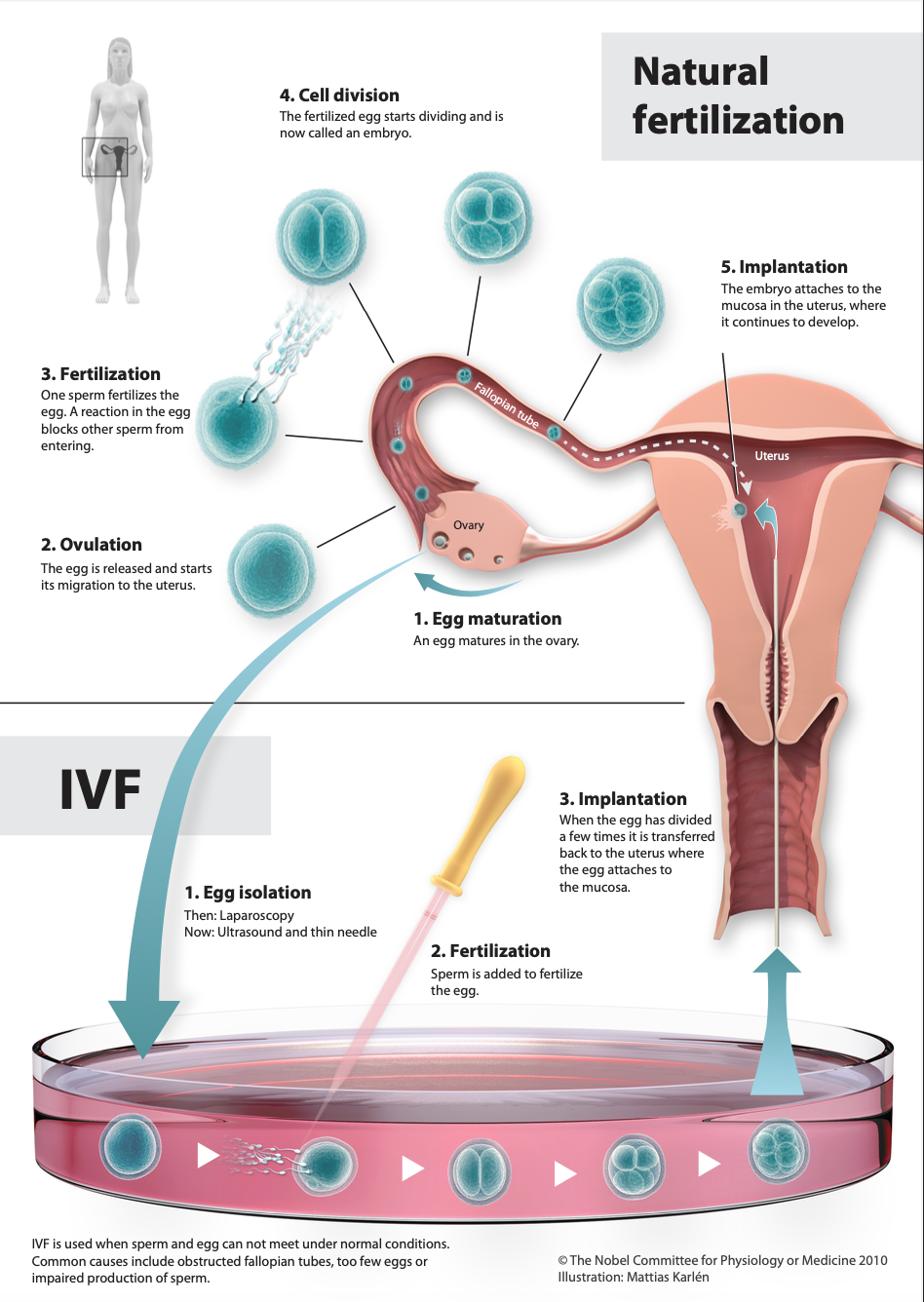
© The Nobel Committee for Physiology or Medicine. Illustrator: Mattias Karlén
Kinder zu bekommen scheint die normalste Sache der Welt, aber gesundheitliche Ursachen können einer Familiengründung im Weg stehen. Dieses Problem ist weiter verbreitet, als man denken mag: jedes zehnte Paar in Deutschland hat Schwierigkeiten, auf natürlichem Wege ein Kind zu bekommen. Die moderne Reproduktionsmedizin ist für viele daher die einzige Chance auf Nachwuchs und was Ende der Siebziger bei der Geburt des ersten Retortenbabys noch eine Revolution war, ist heute medizinischer Alltag. Mittlerweile sind mindesten 6,5 Mio. Kinder weltweit nach In-vitro-Fertilisation (IVF) oder intracytoplasmatischer Spermiuminjektion (ICSI) geboren worden [1]. Den Grundstein für diese bahnbrechende medizinische Entwicklung legten die Arbeiten des Genetikers Robert Geoffrey Edwards, der zunächst die frühe Entwicklung befruchteter Eizellen aus der Maus und dem Kaninchen im Reagenzglas untersuchte [2,3]. Diese Ergebnisse konnte er nachfolgend auf menschliche Embryonen anwenden und schließlich tatsächlich erfolgreich menschliche Eizellen in vitro befruchten [4]. Edwards wurde für seine Experimente an Embryonen stark kritisiert und auch persönlich angefeindet, aber die Unterstützung von Patienten bestärkte ihn darin, seine Forschung weiter voranzutreiben. Es ist seiner Entschlossenheit zu verdanken, dass Unfruchtbarkeit heutzutage kein unveränderliches Schicksal mehr ist. Für die Entwicklung der In-vitro-Fertilisation wurde Edwards 2010 mit dem Nobelpreis für Physiologie und Medizin ausgezeichnet.
[1] Jahrbuch 2017, D·I·R Deutsches IVF-Register
[2] Edwards, R.G., “Meiosis in ovarian oocytes of adult mammals” Nature, 1962. 196: p. 446–450
[3] Cole, R.J., R.G. Edwards and J. Paul, “Cytodifferentiation in cell colonies and cell strains derived from cleaving ova and blastocysts of the rabbit,” Exp Cell Res, 1965. 37: p. 501–504.
[4] Edwards, R.G., “Maturation in vitro of human ovarian oocytes,” Lancet, 1965. 286: p. 926–929.